9月24日,药物临床试验登记与信息公示平台官网显示,辉瑞登记了一项在既往接受过治疗的程序性细胞死亡配体1(PD-L1)阳性非小细胞肺癌(NSCLC)成人研究参与者中评价研究药物PF-08046054/SGN-PDL1V相比多西他赛的III期临床研究。
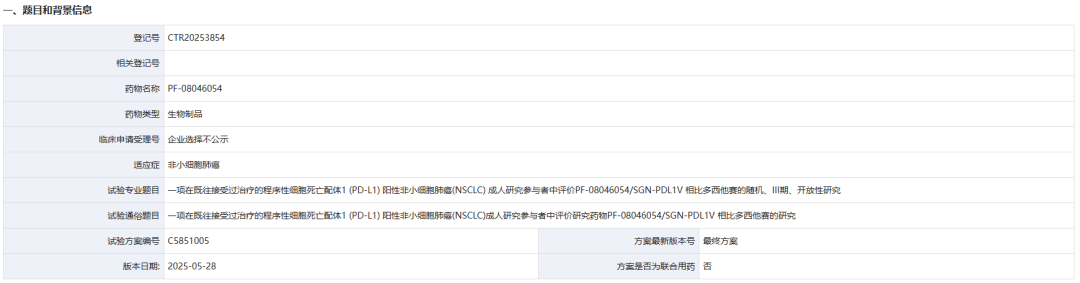
这是一项随机、III期、开放性研究,旨在肿瘤细胞PD-L1表达≥1%,且在PD-(L)1抑制剂、含铂化疗和靶向治疗方案(对于具有已知可靶向基因组改变的研究参与者)治疗期间或治疗后出现疾病进展的局部晚期、不可切除或转移性NSCLC研究参与者中,确定PF-08046054单药治疗与标准治疗多西他赛单药治疗相比是否可改善临床结局。研究的主要终点是OS和BICR根据RECISTv1.1评估的PFS。
PF-08046054(SGN-PDL1V)是辉瑞收购Seagen获得的一款靶向PD-L1的ADC。在2025年ASCO大会,辉瑞公布了一项该药的实体瘤I期研究(C5851001)数据。
C5851001包含一个I期安全性导入队列(D),招募未经治疗的R/MHNSCC患者,其PD-L1CPS≥1,且未接受过PD-1/PD-L1单抗治疗。以21天为一个周期,第一组患者在第1天和第8天接受1.25mg/kg的PF-08046054治疗。在证明安全性后,第二组患者剂量调整为1.5mg/kg。所有患者每3周接受200mg的K药治疗。
截至2024年12月20日,已有14名患者接受给药,中位年龄为61岁。8名患者接受1.25mg/kg治疗,6名患者接受1.5mg/kg治疗。数据截止时,8名患者仍在接受有效治疗。
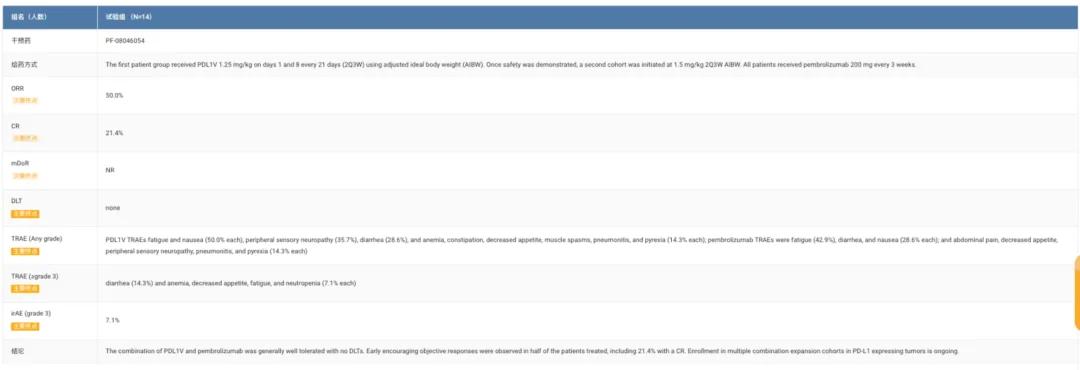
结果显示,对于14例可评估疗效的患者,研究者评估的ORR为50.0%,CR为21.4%。尚未达到中位缓解持续时间。
安全性方面,未观察到剂量限制性毒性(DLT)。最常见的TRAE为疲劳和恶心、周围感觉神经病变、腹泻等,K药的TRAE包括疲劳、腹泻和恶心等。两种药物最常见的≥3级TRAE包括腹泻(14.3%)和贫血、食欲下降、疲劳和中性粒细胞减少症(各占7.1%)。经研究者评估,7.1%的患者观察到治疗相关的免疫介导不良事件,其中7.1%为3级。



